 |
 |
- Search
| Neonatal Med > Volume 30(3); 2023 > Article |
|
Abstract
Purpose
Methods
Results
ARTICLE INFORMATION
Ethical statement
This study was approved by the Institutional Review Board of Seoul National University Bundang Hospital (IRB No. B-1305-202-005). Written informed consent by the patients was waived due to a retrospective nature of our study.
Figure┬Ā1.
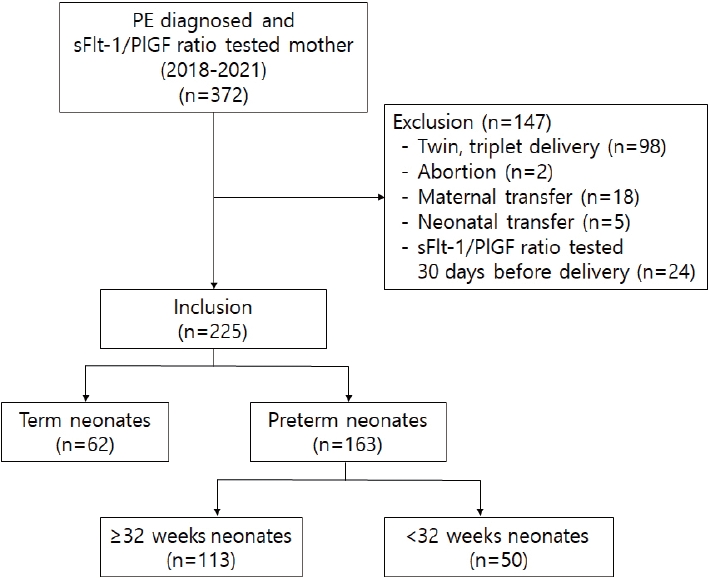
Figure┬Ā2.
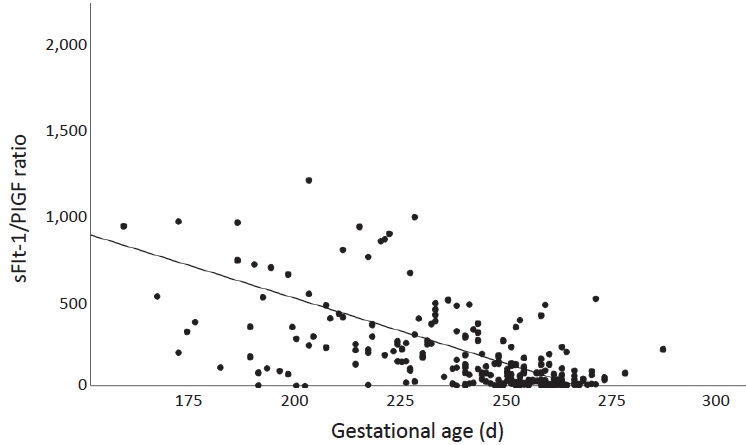
Figure┬Ā3.
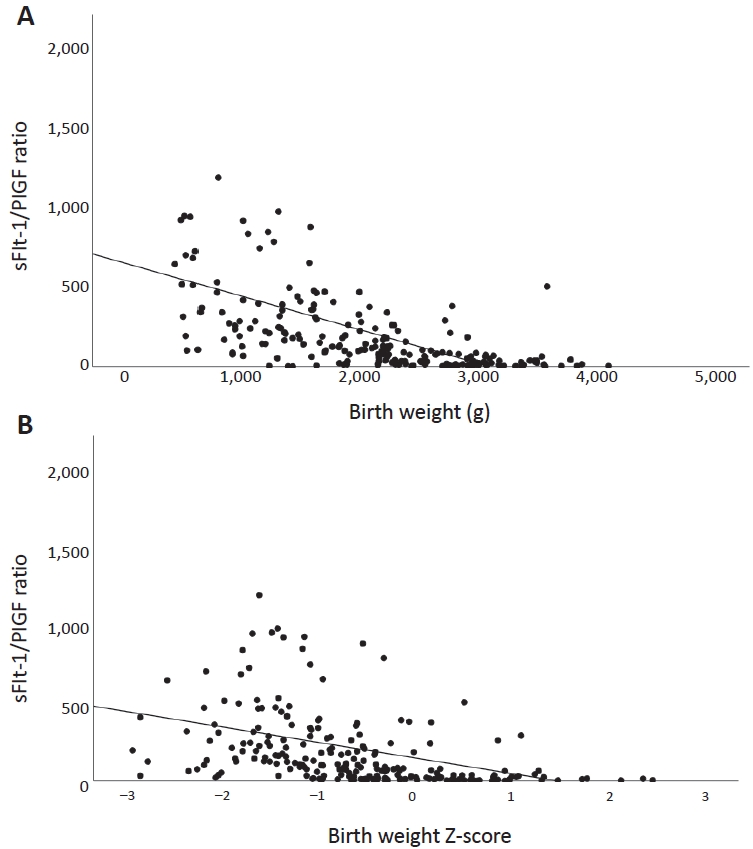
Figure┬Ā4.
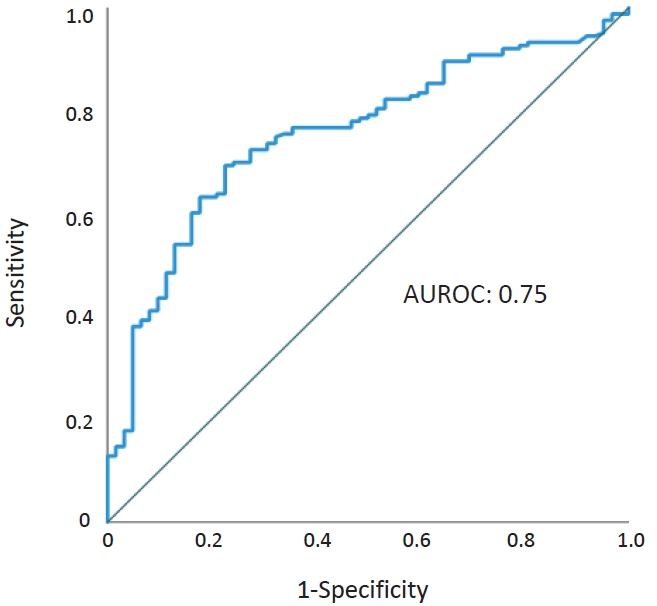
Table┬Ā1.
Values are expressed as mean┬▒standard deviation, median (range), or number (%).
Abbreviations: RDS, respiratory distress syndrome; BPD, bronchopulmonary dysplasia; IVH, intraventricular hemorrhage; PVL, periventricular leukomalacia; ROP, retinopathy of prematurity; NEC, necrotizing enterocolitis; MOP, meconium obstruction of prematurity.
Table┬Ā2.
| Gestational group | Number | sFlt-1/PlGF ratio |
|---|---|---|
| GA <32 weeks | 50 | 534.4┬▒666.7 |
| 32 weeksŌēż GA <37 weeks | 113 | 149.3┬▒159.7 |
| ŌēźGA 37 weeks | 62 | 67.1┬▒105.0 |
| Overall | 225 | 212.2┬▒379.0 |
Table┬Ā3.
Table┬Ā4.
| Variable | Yes/No | Number | sFlt-1/PlGF ratio | P-value | P-value* |
|---|---|---|---|---|---|
| Neonatal death | Y | 10 | 922.7┬▒1,165.4 | 0.038 | 0.234 |
| N | 40 | 437.4┬▒443.5 | |||
| RDS | Y | 33 | 530.2┬▒702.8 | 0.951 | 0.239 |
| N | 17 | 542.6┬▒610.9 | |||
| BPD | Y | 29 | 455.7┬▒476.7 | 0.769 | 0.679 |
| N | 12 | 410.6┬▒348.1 | |||
| IVH (Ōēźgrade II) | Y | 5 | 1,047.0┬▒1,698.7 | 0.496 | 0.448 |
| N | 45 | 477.5┬▒446.6 | |||
| PVL | Y | 3 | 390.9┬▒266.8 | 0.705 | 0.423 |
| N | 47 | 543.6┬▒684.8 | |||
| ROP (treated) | Y | 2 | 418.3┬▒144.3 | 0.804 | 0.925 |
| N | 48 | 539.3┬▒679.9 | |||
| NEC (Ōēźstage II) | Y | 2 | 449.7┬▒362.0 | 0.857 | 0.467 |
| N | 48 | 537.9┬▒678.4 | |||
| MOP (treated) | Y | 6 | 293.2┬▒197.0 | 0.350 | 0.069 |
| N | 44 | 567.3┬▒702.0 | |||
| Sepsis | Y | 15 | 536.8┬▒617.6 | 0.987 | 0.471 |
| N | 35 | 533.4┬▒695.3 | |||
| Thrombocytopenia | Y | 24 | 711.1┬▒875.4 | 0.070 | 0.355 |
| N | 26 | 371.4┬▒329.4 |
Abbreviations: sFlt-1, soluble fms-like tyrosine kinase 1; PlGF, placental growth factor; GA, gestational age; RDS, respiratory distress syndrome; BPD, bronchopulmonary dysplasia; IVH, intraventricular hemorrhage; PVL, periventricular leukomalacia; ROP, retinopathy of prematurity; NEC, necrotizing enterocolitis; MOP, meconium obstruction of prematurity.







