Diagnostic Clues for Congenital Cytomegalovirus Infection: Association with Newborn Hearing Screening Tests
Article information
Abstract
Purpose
To investigate clinical markers for the diagnosis of congenital cytomegalovirus (CMV) infection and determine the correlation between abnormal newborn hearing screening results and asymptomatic congenital CMV infection.
Methods
Medical records of newborns with congenital CMV infection, born at Cheil General Hospital & Women's Healthcare Center from July 2008 to June 2018, were retrospectively reviewed. Infants with congenital CMV infection were classified into “symptomatic,” “asymptomatic,” and “asymptomatic with isolated abnormal automated auditory brainstem response (AABR)” groups. Clinical data were analyzed based on this classification.
Results
Among the 59,424 live births, congenital CMV infection was found in 25 neonates, including 19 symptomatic (0.03%) infants, two asymptomatic, and four asymptomatic with isolated abnormal AABR. Diagnostic clues for the identification of congenital CMV infection were intrauterine growth restriction (IUGR), including microcephaly in 10 infants (40.0%), abnormal AABR in four (16.0%), initial complicated signs in four (16.0%), and abnormal findings on brain ultrasonography in three (12.0%). Other less common markers included petechiae, abnormal findings on antenatal ultrasonography, and co-twin with CMV infection. During the recent 10 years, 53,094 of 59,424 newborns (89.3%) had AABR for hearing screening and 493 (0.9%) did not pass. Among them, 477 (96.8%) were screened for CMV, and results were positive for seven (1.5%). Among the seven infants, four had asymptomatic congenital CMV infection. Overall, 0.8% of the newborns with abnormal AABR (four of 477 infants) were diagnosed as having asymptomatic congenital CMV infection.
Conclusion
The incidence of symptomatic congenital CMV infection was 0.03%, and 0.8% of infants who failed in the newborn hearing screening tests had asymptomatic congenital CMV infection. The most common clinical marker to diagnose congenital CMV infection was IUGR, including microcephaly, and the second isolated marker was abnormal AABR.
서론
거대세포바이러스(cytomegalovirus, CMV)는 전 세계적으로 퍼져 있어 가장 흔하게 선천성 감염을 일으키는 Herpes과에 속하는 바이러스이다[1-3]. 선천성 CMV 감염증은 CMV의 자궁내 감염에 의한 것으로 선진국에서의 유병률은 약 0.5%–1.0%, 아시아 및 아프리카에서는 1%–3%로 더 높은 빈도로 발생하고 있다[3,4]. CMV의 전파는 사람 대 사람으로 이루어지며 전염력이 높지 않기 때문에 체액 또는 감염된 분비물의 밀접한 접촉에 의해 이루어지고 혈액, 소변, 정액, 자궁경부 분비물, 타액, 모유, 이식된 장기 등을 통해 전염된다[2]. 자궁내 전파는 태아 또는 신생아의 심각한 후유증을 초래할 수 있으며, 산모의 초회 감염이나 임신 전반기에 감염되는 것이 그렇지 않은 경우보다 예후가 더 나쁜 것으로 알려져 있다[1].
선천성 CMV 감염의 약 10%–15%는 출생 시 임상적인 증상을 보이는 반면, 나머지 85%–90%는 무증상성으로 나타난다. 하지만 무증상성 감염의 경우도 약 15%에서 발달 장애, 감각 신경성 난청과 같은 신경학적 후유증이 발생할 수 있어 선진국에서 소아의 청력 손실 및 정신 발달 지연의 가장 흔한 바이러스성 원인으로 알려져 있다[5,6]. 선천성 CMV 감염은 소아 난청의 10%–20%를 차지하는 중요한 원인이며 신생아의 청력 선별검사 이상 소견을 보인 환아 중 약 5%에서 선천성 CMV 감염증이 보고되고 있다[7,8].
우리나라의 선천성 CMV 감염률은 Sohn 등[9], Lee 등[10]에 의한 연구에서 약 1.2%로 보고된 바 있으나 아직 정확하게 알려져 있지 않으며, 증상성 선천성 CMV 감염의 빈도에 대해서는 연구된 바가 없다. 또한 선천성 CMV 감염증의 임상증상, 진단법, CMV 감염증과 lenticulostriate vasculopathy (LSV)와의 연관성, 신경학적 예후에 관한 연구가 진행되었으나[11-15], 선천성 CMV 감염증의 진단을 위한 임상적 근거와 신생아의 청력 선별검사와의 연관성에 대한 연구는 부족한 실정이다. 이에 본 연구는 증상성 선천성 CMV 감염과 청력 선별검사를 통한 CMV 감염의 빈도 및 선천성 CMV 감염의 진단적 단서로서의 임상적 근거와 청력 선별검사에 대해서 알아보고자 하였다.
대상 및 방법
2008년 7월 1일부터 2018년 6월 30일까지 제일병원에서 출생한 신생아 중에서 생후 3주 이내에 시행한 소변 중합효소연쇄반응(polymerase chain reaction, PCR) 및 배양검사에서 CMV 감염증이 확인된 환아들의 의무기록을 본원의 임상연구윤리위원회의 승인 하에 후향적 연구를 진행하였으며, 동의서는 면제되었다(IRB No. CGHIRB-2018-34). 이들의 출생 시 재태 연령, 출생체중, 두위 등의 신체 계측, 성별, 분만 방식, 쌍생아, 아프가 점수, 산전 초음파 결과 등의 주산기 임상소견과 혈액검사, 영상의학적 검사, 청력 선별검사 등에 대한 임상자료를 검토하였다. 또한 CMV 감염증 환아에서 자궁내 성장지연(intrauterine growth restriction, IUGR) (출생체중 <10 p), 소두증(머리둘레 <3 p), 점상 출혈, 간비종대, 조기 황달, 혈소판감소증(혈소판 수 <100,000/mm3), 청력 선별검사 이상, 뇌초음파 또는 산전 초음파에서 두개내 석회화 등 선천성 CMV 감염에 관한 임상증상을 조사하였고, 각 환아들에게 CMV 진단검사를 시행하게 된 근거를 진단적 단서로 정하였다.
연구 기간 동안 본원에서 출생한 신생아에게 청력 선별검사로 ALGO Newborn hearing screener (Natus Medical Incorporated, San Carlos, CA, USA)를 이용하여 35 dB의 청각자극에 대한 자동화 청성 뇌간반응(automated auditory brainstem response, AABR)을 검사하여 “pass” 또는 “refer”의 결과를 얻었다. 1차 검사는 출생 2일째 시행하였고, 통과하지 못한 경우에는 신생아실 퇴원 전 2차 검사를 시행하여 오른쪽 또는 왼쪽 중 한곳이라도 통과하지 못하는 경우 청력 선별검사 결과 이상으로 정의하였다. 청력 선별검사 이상 소견으로 시행한 CMV 선별검사에서 CMV 감염증으로 진단된 환아에 대한 임상 자료를 분석하였고, 이들에게 안과적 검사, 뇌초음파를 시행하여 CMV 관련 합병증에 대한 평가를 시행하였다.
결과
1. 대상 환아의 임상적 특징
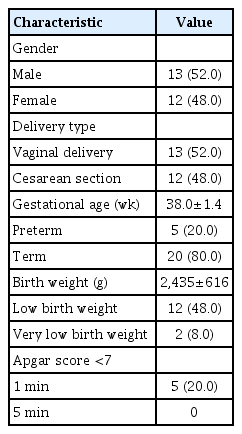
본원에서 연구 기간 동안에 출생한 신생아는 총 59,424명이었고, 이 중에서 선천성 CMV 감염으로 진단된 환아는 총 25명(0.04%)으로 소변 CMV PCR 검사는 모든 환아에서 양성이었고 소변 CMV culture 검사는 24명에서 시행하여 18명(75%)에서 양성이었다. 25명의 선천성 CMV 감염 중에서 증상성 19명(0.03%), 무증상성 2명, 청각 선별검사 이상으로 진단된 무증상성 감염이 4명이었다. 남아 13명, 여아 12명이었고, 평균 재태 연령은 38.0±1.4주, 평균 출생체중은 2,435±616 g, 37주 미만 미숙아는 5명(20.0%), 저체중출생아 12명(48.0%), 극소저체중출생아는 2명(8.0%) 이었다(Table 1).
증상성 선천성 CMV 감염증 환아 19명의 임상소견은 IUGR이 12례(63.2%)로 이중 7례는 소두증을 동반하고 있었으며, 혈소판감소증 4례(21.1%), 점상 출혈 2례(10.5%), 조기 황달, CMV 폐렴, 비장종대, 간석회화가 각각 1례, 뇌초음파 이상은 11례(57.9%), AABR 이상이 2례(10.5%)에서 관찰되었다. 뇌초음파 이상 소견은 총 11례로 LSV 소견이 9례로 가장 많았고, 격벽이 있는 낭포성 병변(septated cystic lesions) 6례, 뇌실확장증(ventriculomegaly) 4례, 두개내 석회화(intracranial calcification) 2례가 관찰되었다(Table 2). 혈청 CMV IgM 검사는 19명에서 시행하여 6명(31.6%)에서 양성이었고, 뇌척수액 CMV PCR 검사는 3명에서 시행하였는데 모두 음성이었다. 선천성 CMV 감염증 환아 중에서 신생아집중치료실에 입원한 환아는 15명(60.0%)으로, 이 중 ganciclovir 또는 valganciclovir 치료를 받은 환아는 5명(20.0%)이었고, 10명(40.0%)은 신생아실에서 퇴원하였다.
2. 선천성 CMV 감염증의 진단적 단서
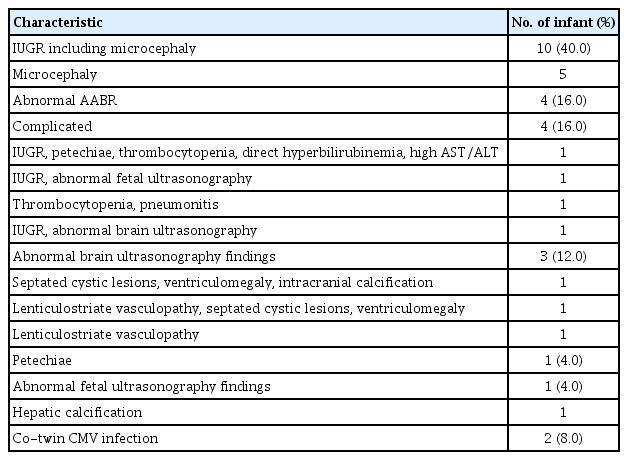
선천성 CMV 감염에 대한 진단적 단서로서 단순 증상으로는 소두증 5례(20.0%)를 포함한 IUGR 10례(40.0%), 청각 선별검사 이상 4례(16.0%), 뇌초음파 이상 소견 3례(12.0%), 혈소판감소증 1례(4.0%), 산전 초음파 이상 소견 1례(4.0%)로 19례였으며, 복합적 증상이 처음에 관찰되었던 경우는 총 4례(16.0%)로 소두증을 동반한 IUGR, 점상출혈, 혈소판감소증, 고직접 빌리루빈혈증, 간기능 이상이 있었던 환아 1례, 소두증을 동반한 IUGR, 산전 초음파 이상 환아 1례, 혈소판감소증, CMV 폐렴 소견 1례, IUGR, 뇌초음파 이상이 동반된 1례가 진단되었으며, 그 외에 쌍생아 중 1명이 진단되어 나머지 쌍생아에서 시행한 검사에서 무증상성 감염 2례(8.0%)가 발견되었다(Table 3).
3. 선천성 CMV 감염증과 청력 선별검사 이상과의 연관성
연구 기간 동안에 본원에서 출생한 59,424명의 신생아 중에서 퇴원 전 신생아실 또는 신생아집중치료실에서 53,094명(89.3%)이 청력선별검사로 AABR을 시행하였고, 이 중 493명(0.9%)에서 이상 소견이 발견되었다. 소이증 등 귀의 선천성 기형이 있는 환아 9명, 심각한 저산소성 허혈성 뇌병증 환아 2명, 뇌사 판정을 받은 환아 1명과 기타 이유로 검사를 시행하지 못한 4명을 제외한 477명(96.8%)에서 소변 CMV PCR 및 배양검사를 시행하였고, 이 중 7명(1.5%)에서 CMV 감염증이 진단되었다. 이들 7명 중에서 4명(57.1%)은 청력 선별검사 이상 외에 다른 선천성 CMV 감염증과 관련된 증상이 없는 무증상성 선천성 감염을 보인 만삭아였고, 청력 선별검사 이상 환아의 0.8% (4/477)에서 발견되었다. 이외 2명은 증상성 선천성 감염이었고 1명은 재태 연령 30주에 출생한 미숙아로 생후 52일째 발견된 무증상성 감염이었다(Figure 1).
고찰
선천성 CMV 감염증은 전 세계에서 약 0.2%–3%의 높은 유병률을 보이고 있으며 심각한 선천성 장애, 발달 지연, 감각 신경성 난청의 대표적인 비유전적 원인으로 작용하는 질환이다[2-4]. 전 세계적으로 가임기 여성의 항체 보유율은 40%에서 90% 이상으로 보고되고 있으며 지역에 따라 차이가 있어 미국 50%–88%, 서유럽 40%–70%인 반면 남미, 아프리카, 남아시아 국가에서는 95% 이상으로 알려져 있다[1,16]. 2009년에 시행된 국내 연구에서는 98.1%의 산모에서 CMV IgG가 양성이었고 1.7%에서 IgM 양성임을 보고하였으며, 일본에서도 94%의 높은 항체 보유율을 보이고 있다[17,18]. 초회 감염 시 약 14.2%–52.4%에서 자궁내 감염이 일어나는 반면 재활성화 또는 재감염인 경우에는 1.1%–1.7%로 감염률이 낮지만 CMV의 높은 항체 보유율을 고려하게 되면 선천성 CMV 감염의 3분의 2 이상이 기존에 항체를 보유하고 있던 산모에 의한 것임을 알 수 있다[1-3].
증상성 선천성 CMV 감염증은 전체 선천성 CMV 감염의 약 10%–15%로 이에 대한 명확한 진단 기준은 없으나, 출생 시 점상출혈, 혈소판감소증, 간비종대, 황달, IUGR과 소두증, 두개내 석회화, 맥락망막염 등과 같은 중추신경계 증상을 보이는 경우로서, 이들의 40%–60%는 인지장애, 망막염, 뇌성마비, 청력 소실과 같은 영구적인 후유증이 남는 것으로 알려져 있다[4,5]. 나머지 85%–90%는 출생 시 무증상성으로 나타나지만 약 15%에서 발달 장애, 특히 감각 신경성 난청과 같은 신경학적 후유증이 발생하는 것으로 알려져 있다[5,6]. 청력 선별검사에서 발견되는 감각 신경성 난청은 출생 시 명확한 증상을 보이지 않아 일부에서는 무증상성 감염으로 분류하는 경우도 있으며[19], 신생아 청력 선별검사가 확대되면서 이를 통해 무증상성 선천성 CMV 감염증이 발견되는 경우가 늘어나고 있다. Kenneson와 Cannon [18]의 메타분석에서 27개 연구를 종합하여 증상성 선천성 CMV 감염증의 유병률을 0.07%로 보고하였으며, 본 연구에서는 0.03%로 다소 낮은 경향이 있었다. 출생 시 관찰된 임상증상으로는 IUGR이 가장 높은 빈도로 관찰되었고 소두증, 점상 출혈, 뇌초음파 이상, 혈소판감소증, 청력 선별검사 이상, 조기 황달, 폐렴, 비장종대, 간석회화 등이 있었다. 이는 기존의 연구 결과와 비교하였을 때 IUGR, 소뇌증, 뇌초음파 이상이 관찰된 비율은 큰 차이가 없었으나, 점상 출혈, 혈소판감소증, 조기 황달 등의 다른 증상은 낮게 관찰되었다[3].
선천성 CMV 검사의 적응증은 아직 명확한 기준은 없으나 2015년 European Society for Paediatric Infectious Diseases (ESPID)에서는 산전 영상검사에서 CMV 감염이 의심되는 경우, 산모의 CMV 초회 감염이 의심되는 경우, 신생아에서 CMV와 관련된 신체 진찰 소견 및 혈액검사 이상, 뇌영상 검사 이상, 청력 검사 이상, 우연히 발견된 맹락망막염 등의 안과 검사 이상 소견이 보일 때 시행해야 하는 것으로 지침을 발표하였다[19]. 본 연구에서 선천성 CMV 감염의 진단을 위한 임상적 근거로는 소두증을 포함한 IUGR이 가장 높은 비율을 차지하였고 그다음으로 청각 선별검사 이상, 동시에 복합적 증상이 관찰된 경우, 뇌초음파 이상 순서로 관찰되었다. 청각 선별검사 이상으로 진단된 경우가 16.0% (4/25)로 두 번째로 높게 관찰되었고, Stehel 등[8]의 연구에서도 선천성 CMV 감염 환아 50명 중에서 19명(38.0%)이 청력 선별검사 이상으로 발견되었다.
청력 선별검사 이상을 보이는 신생아를 대상으로 CMV 진단검사를 시행하는 CMV 표적 선별검사(targeted screening)는 선택적인 CMV 선별검사로서 미국의 일부 주에서는 의무적으로 시행하고 있다[20]. 본원에서는 2004년도에 신생아 청력 선별검사를 시행한 이래 검사 이상을 보이는 경우에 CMV 검사를 고려하였으나, 2008년 이후부터는 청력 선별검사 이상 소견을 보이는 모든 신생아에게 CMV 선별검사를 시행하는 방침을 따르고 있다. Stehel 등[8]의 연구에서 청력 선별검사 이상 소견을 보인 신생아의 5% (24/483)에서 선천성 CMV 감염이 발견되었고, 이들 중 63% (15/24)는 청력 이상 외에 다른 증상이 없는 무증상성 감염이었다. 이외 CMV 표적 선별검사에 대한 다른 연구로 Rawlinson 등[21]과 Diener 등[20]의 연구에서도 청력 검사 이상 소견을 보인 환아의 5.9% (19/323)와 6% (14/234)에서 선천성 CMV 감염이 진단되었다. 본 연구는 국내에서 처음으로 CMV 표적 선별검사에 대하여 조사한 연구로 청력 선별검사 이상 소견을 보인 환아 중 1.5% (7/475)에서 선천성 CMV 감염증이 발견되었고 그 중에서 57.1% (4/7)의 환아는 무증상성이었다. Stehel 등[8]의 연구에서는 신생아의 99%에서 청력 선별검사를 시행하여 이 중 0.7%에서 이상 소견을 보였으며, 본 연구에서는 신생아 청력 선별검사 시행률이 89.3%로 다소 낮았으나 청력 검사 이상 소견은 0.9%로 비슷하였다. 청력 선별검사 이상 환아에서 CMV 진단검사를 시행한 비율이 Stehel 등[8] 연구에서의 84%보다 본 연구에서는 96.9%로 높았던 것에 비하여 이들 중 CMV 감염이 발견된 비율은 1.5%로 위에서 언급한 기존의 연구들[8,20,21]에 비해 발견율이 낮았으나 청력 선별검사 이상으로 진단된 선천성 CMV 감염증 중에서 무증상성 감염의 비율은 57.1%로서 Stehel 등[8]의 연구에서의 63%와 큰 차이가 없었다. 향후 청력 선별검사를 통한 CMV 발견율의 차이에 대한 추가적인 연구가 필요할 것으로 생각된다.
무증상성 선천성 CMV 감염증의 약 10%는 감각 신경성 난청, 5%는 신경발달 손상, 2%에서 맹락망막염과 같은 신경학적 후유증이 나중에 진행할 수 있기 때문에 청력 검사, 안검사, 신경 발달에 대한 정기적인 추적검사를 권하고 있다[5,6,22]. 그러나 출생 시 청력 선별검사가 정상인 경우에는 CMV 표적 선별검사를 시행하지 않으므로 무증상성 CMV 감염증의 진단이 어려울 수 있다. 청력 손실을 조기에 진단하여 치료할수록 언어 발달, 인지 발달에 도움이 되고[23], 중추신경계 증상을 보이는 경우에 생후 1개월 전에 진단하여 항바이러스제 치료를 하는 것이 청력 손실의 진행을 예방하고 정상적인 청력을 유지하는 데 효과적이라는 면에서 선천성 CMV 감염의 조기 진단은 매우 중요하며[8,20], 모든 신생아에게 보편적인 CMV 선별검사(universal screening)를 시행하는 것이 비용대비 효과를 분석했을 때에도 필요하다는 연구 결과가 최근 발표되고 있다[24,25]. 특히 재태 연령 34주 미만의 미숙아나 신생아집중치료실에서 치료받는 아기들은 생후 3주 이전에 청력 선별검사를 시행하지 못하는 경우가 많아 청력 선별검사를 통한 CMV 표적 검사보다 보편적인 CMV 선별검사의 필요성이 제기되고 있다[22,26]. 본원의 신생아집중치료실에서는 보편적인 CMV 선별검사는 시행하지 않고 있으며, 재태 연령 30주의 미숙아에서 생후 52일째 시행한 청력 선별검사 이상으로 진단된 무증상성 CMV 감염 1례가 있었다. 보편적 CMV 선별검사 방법으로 소변 CMV PCR 검사법 외에도 Dried blood spots를 이용하여 신생아 대사 이상 검사와 동시에 시행하는 방법이 있으나 Boppana 등[27]에 의하면 특이도는 높으나 민감도는 28.3%로 낮은 단점이 있었고, 97.4%–100%의 높은 민감도를 보이는 타액 검사법은 소변 채취보다 검사법이 쉬워 선별검사로 선호되지만, 소변 CMV PCR 검사로 확진이 필요하고 비용 문제가 있어 보편적인 CMV 선별검사의 적절한 방법에 대한 연구가 필요하다[22,28].
결론적으로, 본 연구에서 증상성 선천성 CMV 감염증의 유병률은 0.03%였으며, 청력 선별검사 이상 환아의 0.8%에서 무증상성 선천성 CMV 감염이 발견되었다. 선천성 CMV 감염의 진단을 위한 임상적 근거로는 소두증을 포함한 IUGR이 가장 높은 비율을 차지하였고, 그다음으로 청력 선별검사 이상, 복합적 증상, 뇌초음파 이상 순서였다. 따라서 선천성 CMV 감염의 진단을 위한 표준화된 특별한 임상적 근거가 부족하고, 신생아 청력 선별검사를 통한 선택적인 CMV 선별검사로는 대부분의 무증상 감염과 경한 증상성 감염의 진단이 어렵기에, 보편적인 CMV 선별검사에 대한 기초자료가 될 수 있는 무증상 감염에 대한 연구가 필요할 것으로 생각된다. 본 연구의 제한점으로는 모집단이 단일 기관에 국한된 점, 모든 신생아에게 청력 선별검사를 시행하지 못한 점과 AABR 검사 이상 소견이 있던 환아들의 확진 검사 결과 및 추후에 진행하는 청력 이상에 대한 추적 관찰이 이루어지지 못한 점이 있다. 보편적인 CMV 선별검사에 대한 정해진 방법이나 비용대비 효과에 대해 발표된 대규모의 연구가 아직 없으며 선택적인 CMV 선별검사를 통해 진단된 무증상성 환아에서 시행할 추가 검사의 범위, 치료 적응증, 추적검사 등에 대한 지침이 없기에 이에 대한 연구가 이루어져야 할 것이다.
Notes
본 저자는 이 논문과 관련된 이해관계가 없음.